新(xīn)聞中(zhōng)心
在《Biacore檢測蛋白與小(xiǎo)分(fēn)子相互作(zuò)用(yòng)的常見問題(上)》中(zhōng)我們着重介紹了在實驗設計以及樣品準備方面的問題,在本文(wén)的下篇中(zhōng),我們還是從智荟專線(xiàn)收集的客戶咨詢出發,将繼續讨論在實驗進行過程中(zhōng)和最終的數據分(fēn)析階段可(kě)能(néng)遇到的常見問題,并逐一揭開上篇中(zhōng)遺留的各個懸念……
一、 關于溶劑校正的問題
溶劑校正流程貫穿于前期的樣品準備、之後的樣品檢測以及最後的數據分(fēn)析,是檢測蛋白與小(xiǎo)分(fēn)子相互作(zuò)用(yòng)實驗中(zhōng)非常關鍵的一個步驟,也是Biacore檢測蛋白與小(xiǎo)分(fēn)子互作(zuò)的一大優勢。
什麽情況下需要進行溶劑校正?
當運行緩沖液中(zhōng)含有(yǒu)高折光率(refractive index)的成分(fēn),且此時在活通道上的配體(tǐ)量較高時,運行緩沖液流經活性通道時會存在一定的體(tǐ)積排阻效應,導緻活性通道與參比通道上的信号存在差異[1](如下圖1所示)。

1. 運行緩沖液的高折光率與高偶聯造成活性通道與參比通道的信号差異[1]。
如果運行緩沖液以及不同濃度的分(fēn)析物(wù)樣品的折光率能(néng)保持嚴格一緻,則上述的通道間差異也是一個定值了,将不會對最終互作(zuò)結果産(chǎn)生影響;然而實際情況下,由于樣品配制誤差等原因,緩沖液與分(fēn)析物(wù)樣品間的折光率誤差往往難以避免。以DMSO為(wèi)例,1% DMSO的加入會導緻響應值信号上升約1200 RU[1],而小(xiǎo)分(fēn)子分(fēn)析物(wù)本身與配體(tǐ)結合産(chǎn)生的響應值是較小(xiǎo)的,因此DMSO濃度的微小(xiǎo)變化也會引起顯著的影響。此時就需要進行溶劑校正,來修正這種由于高折光率物(wù)質(zhì)(例如DMSO等)濃度的細微偏差導緻的響應值信号顯著變化,得到最準确的互作(zuò)數據。
2如何進行溶劑校正?
以最常見的DMSO為(wèi)例,溶劑校正的核心思路是設置一系列含有(yǒu)不同濃度DMSO的校正溶液,濃度範圍覆蓋實驗中(zhōng)所用(yòng)的DMSO濃度(例如運行緩沖液和分(fēn)析物(wù)樣品中(zhōng)均含5% DMSO,則校正溶液中(zhōng)濃度範圍可(kě)以是4.5% - 5.8%),以此來包含樣品與buffer配制過程中(zhōng)引入的DMSO濃度的誤差。使校正溶液按照濃度順序(從低到高或者從高到低)依次進樣,流經參比通道與活性通道後,以參比通道的響應值為(wèi)橫坐(zuò)标、活性通道扣減參比通道的響應值為(wèi)縱坐(zuò)标進行作(zuò)圖,得到溶劑校正曲線(xiàn)(如下圖2所示)。根據樣品在參比通道的信号,就可(kě)以通過校正曲線(xiàn)對應得到活性通道扣減參比通道的校正值。而此過程在Biacore上,都是全自動完成的,有(yǒu)專用(yòng)向導式程序指引,無需手動操作(zuò)。
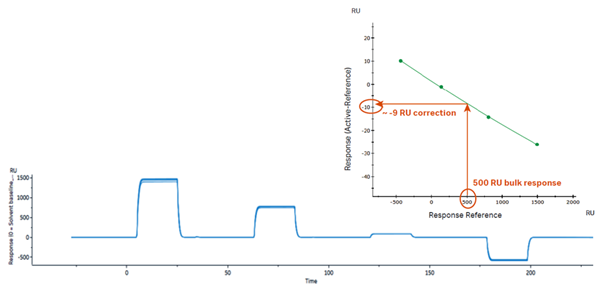
2. 典型的溶劑校正曲線(xiàn)示意圖[1]。
3
如何判斷溶劑校正的結果是否正常?
如果按照上述的例子,對含有(yǒu)5% DMSO的樣品以4.5% - 5.8%的範圍進行溶劑校正,最終得到的溶劑校正曲線(xiàn)橫坐(zuò)标範圍一般要落在-500 到 +1000 RU,校正曲線(xiàn)圖譜中(zhōng)的兩條豎線(xiàn)代表的是分(fēn)析物(wù)中(zhōng)DMSO濃度範圍,要求落在校正曲線(xiàn)的範圍内,并且拟合的Chi²值小(xiǎo)于2[1][2]。
如果溶劑校正的結果出現異常,可(kě)以留意以下幾方面的問題:(1)建議使用(yòng)高品質(zhì)的DMSO試劑,并且使用(yòng)相同來源的DMSO溶解小(xiǎo)分(fēn)子和配制所需溶液。(2)注意校正溶液的配制策略,例如隻需配制含4.5%和5.8% DMSO的這兩種緩沖液,中(zhōng)間梯度通過這兩種溶液按照不同比例混合得到,而不需要一個個單獨配制。(3)由于DMSO具(jù)有(yǒu)吸潮的性質(zhì),在配制過程中(zhōng)應及時封閉,避免長(cháng)時間敞口放置;在上機檢測時,也應該對樣品管進行密封。為(wèi)此,Biacore獨特的全密閉樣品艙設計,及配套專用(yòng)的孔闆封膜及EP管橡膠蓋就派上用(yòng)場了。
關于溶劑校正步驟的具(jù)體(tǐ)操作(zuò)方法,可(kě)以掃描文(wén)末二維碼,查閱《Easy Biacore: T200 檢測蛋白與小(xiǎo)分(fēn)子結合》中(zhōng)的相關内容。
二、結果分(fēn)析中(zhōng)的相關問題
正确的溶劑校正是後續進行數據分(fēn)析的前提,得到最終可(kě)分(fēn)析的結果後,可(kě)能(néng)還面臨下面這些問題。
1
應該選擇哪種拟合模式?
關于拟合模式的選擇,是選擇動力學(xué)(Kinetics)分(fēn)析還是親和力(Affinity)分(fēn)析,主要是根據響應值圖譜的形狀來判斷的。對于動力學(xué)分(fēn)析,要求響應值圖譜在結合和解離階段均展現出足夠的曲率(“慢結合慢解離”),而親和力分(fēn)析則要求在每次的分(fēn)析物(wù)進樣階段均達到穩态(steady state)。對于同時滿足兩種要求的響應值圖譜,理(lǐ)論上兩種分(fēn)析模式均可(kě)以使用(yòng)。關于不同響應值圖譜形狀以及可(kě)選的拟合模式,可(kě)參考如下圖3[3]。
3. 不同形狀的響應值圖譜與适用(yòng)的拟合模式的對應關系示意圖[3]。
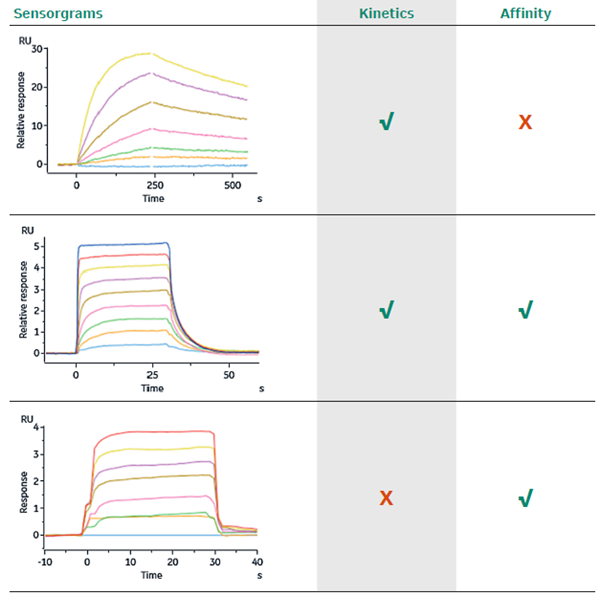
如同在上篇所提到的,蛋白與小(xiǎo)分(fēn)子的相互作(zuò)用(yòng)在大部分(fēn)情況下是“快結合快解離”的,在結合與解離階段的曲線(xiàn)未能(néng)呈現足夠的曲率,而在每次分(fēn)析物(wù)進樣後,曲線(xiàn)快速上升并達到平台,因此适用(yòng)于親和力(Affinity)分(fēn)析。而在解離階段曲線(xiàn)快速下降至接近基線(xiàn)的特點,也使得蛋白與小(xiǎo)分(fēn)子互作(zuò)檢測中(zhōng)一般不需要設置額外的再生步驟。
2
如何判斷拟合結果的好壞?
這是很(hěn)多(duō)實驗者在面對自己的實驗結果時會發出的“靈魂拷問”,同樣也是Biacore另一個獨特優勢體(tǐ)現之處:具(jù)有(yǒu)智能(néng)數據質(zhì)量評估系統,能(néng)夠以圖形化顯示方式來評估檢測結果。能(néng)夠對檢測結果自動進行統計學(xué)分(fēn)析,并給出相應參數,以此判斷數據可(kě)信度與準确度。由于篇幅有(yǒu)限,我們這裏主要讨論蛋白與小(xiǎo)分(fēn)子互作(zuò)常用(yòng)的親和力分(fēn)析結果的評價。
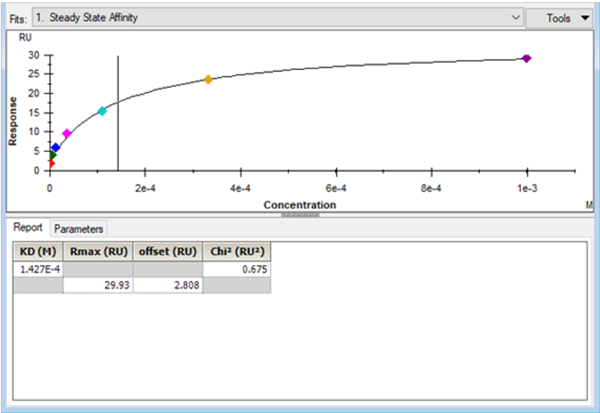
是使用(yòng)Biacore結果分(fēn)析軟件得到的典型的親和力分(fēn)析結果,在Report界面,顯示的參數有(yǒu)KD(以M為(wèi)單位)、Rmax、offset以及Chi²,相應的判斷标準如下:
1
拟合得出的KD值(即拟合曲線(xiàn)中(zhōng)豎線(xiàn)所在的橫坐(zuò)标值)應該盡可(kě)能(néng)落在分(fēn)析物(wù)濃度範圍之内,最好在最高濃度的一半以内。
2
當拟合得到的實際Rmax值顯著高于理(lǐ)論計算值時,說明結合反應未按照1:1的化學(xué)計量比進行,有(yǒu)可(kě)能(néng)出現了非特異性結合或者分(fēn)析物(wù)分(fēn)子的聚集。對于小(xiǎo)分(fēn)子樣品來說,往往由于溶解度等問題發生聚集導緻上述現象。而造成拟合得到的實際Rmax值低于理(lǐ)論計算值的原因,主要還是偶聯的配體(tǐ)中(zhōng)有(yǒu)一定比例的分(fēn)子未充分(fēn)暴露結合活性。如果上述兩種情況同時存在,此時僅通過Rmax值難以判斷,需要通過其他(tā)實驗結果來驗證。
3
offset代表的是零濃度時的響應值,這個值應該趨近于0;如果出現了異常高的值或者負值,需要檢查參比通道和零濃度的響應值 [3] 。
4
Chi²值反映了拟合結果與實驗數據的接近程度,這個值越小(xiǎo),代表實驗結果與拟合模型越接近。
4. Biacore分(fēn)析軟件中(zhōng)典型的親和力拟合結果界面 [2] 。
3
關于非特異性吸附的問題
非特異性吸附的來源是多(duō)樣的,最常見的應該是分(fēn)析物(wù)分(fēn)子在參比通道芯片表面的吸附,其次可(kě)能(néng)還來源于分(fēn)析物(wù)樣品中(zhōng)其他(tā)雜質(zhì)成分(fēn)在參比通道或者配體(tǐ)上的非特異性結合,甚至還可(kě)能(néng)是分(fēn)析物(wù)分(fēn)子在配體(tǐ)上的吸附(例如小(xiǎo)分(fēn)子在配體(tǐ)蛋白非活性位點的弱結合等)。要判斷是否存在非特異性吸附,最主要的判斷依據是看Binding to reference這部分(fēn)參數,該參數反映了每個循環的分(fēn)析物(wù)在參比通道上的吸附情況。作(zuò)為(wèi)建議,可(kě)以按照以下标準判斷:如果Binding to reference的值大于活性通道扣減參比通道(如Fc=2-1)得到信号值的20%,則可(kě)以認為(wèi)存在較顯著的非特異性吸附。
要解決非特異性吸附問題,主要可(kě)以從以下三方面入手:
1
改變芯片表面或者分(fēn)析物(wù)的性質(zhì)。比較直接的方法是調換配體(tǐ)與分(fēn)析物(wù)的位置,即固定會發生非特異性吸附的原分(fēn)析物(wù),将原配體(tǐ)作(zuò)為(wèi)分(fēn)析物(wù)流經芯片表面進行分(fēn)析。然而在蛋白與小(xiǎo)分(fēn)子的互作(zuò)實驗中(zhōng),固定小(xiǎo)分(fēn)子會面臨諸多(duō)問題(如上篇中(zhōng)所述),因此這個方案在解決小(xiǎo)分(fēn)子的非特異性吸附中(zhōng)不常用(yòng)。其次可(kě)以考慮改變參比通道的處理(lǐ)方法。在使用(yòng)CM系列芯片偶聯配體(tǐ)進行檢測時,參比通道可(kě)以不作(zuò)任何處理(lǐ),也可(kě)以進行活化與封閉。這兩種處理(lǐ)方式下的芯片表面性質(zhì)有(yǒu)所不同,改變處理(lǐ)方式或許可(kě)以減弱非特異性吸附。另外,非特異性吸附的來源還可(kě)能(néng)是分(fēn)析物(wù)中(zhōng)的雜質(zhì),那麽提高分(fēn)析物(wù)的純度可(kě)能(néng)也有(yǒu)助于減弱這種吸附。
2
改變緩沖液條件抑制吸附的發生。非特異性吸附發生所依賴的作(zuò)用(yòng)力主要就是離子型相互作(zuò)用(yòng)或者疏水型相互作(zuò)用(yòng),前者可(kě)以通過提高離子強度來抑制,而後者可(kě)以通過添加一定濃度的表面活性劑進行屏蔽。常規緩沖液中(zhōng)NaCl濃度在150 mM附近,可(kě)以考慮在原運行緩沖液中(zhōng)額外添加鹽(至~300 mM甚至500 mM)。Cytiva提供含有(yǒu)表面活性劑P20的運行緩沖液,工(gōng)作(zuò)濃度一般為(wèi)0.05%。需要注意的是,在提高鹽濃度或者加入表面活性劑的過程中(zhōng),配體(tǐ)與分(fēn)析物(wù)的相互作(zuò)用(yòng)可(kě)能(néng)也會受到一定程度的影響。
3
調整分(fēn)析物(wù)的濃度範圍。非特異性吸附往往呈現出非常明顯的濃度相關性。對于小(xiǎo)分(fēn)子分(fēn)析物(wù),有(yǒu)可(kě)能(néng)發生的情況是,當濃度達到某個值以上時,小(xiǎo)分(fēn)子的溶解情況出現變化,容易發生聚集沉澱等問題,導緻非特異性吸附的信号陡然上升。對于上述情況,可(kě)以考慮調整分(fēn)析物(wù)的濃度範圍,将非特異性吸附的信号控制在相對不顯著的範圍之内進行實驗。當然,分(fēn)析物(wù)的濃度範圍的确定還要考慮KD拟合的需要(如上篇中(zhōng)所述),因此這個方法不一定能(néng)找到合适的濃度範圍。
面對實際出現的非特異性吸附問題時,往往是以上三方面綜合考慮,進而嘗試解決。
至此,關于Biacore檢測蛋白與小(xiǎo)分(fēn)子互作(zuò)的實驗進行步驟和數據分(fēn)析過程的常見問題也已分(fēn)享完畢。一個成功的Biacore實驗需要在實驗設計、樣品準備以及結果分(fēn)析等各階段進行問題的排查與調整,檢測蛋白與小(xiǎo)分(fēn)子互作(zuò)的實驗中(zhōng)可(kě)能(néng)會出現形形色色的問題,但是造成這些問題的主要原因應該都在這兩篇讨論的内容中(zhōng)了,很(hěn)多(duō)情況下未知的現象往往是已知的原因導緻的。萬變不離其宗,希望這上下兩篇的分(fēn)享能(néng)給大家帶來一些提示與啓發。
文(wén)章來源:https://mp.weixin.qq.com/s/5MifecpYb03DUZ_sLj15sQ
